抗癌剤を用いた癌の化学療法は、外科手術、放射線治療と共に、癌の治療の大きな部分 を占める。しかしながら現在の癌化学療法の有効性はまだ十分なものとは言えません。
薬剤を感染症やがん患者さんの治療のために投与を続けていると、しばしば薬剤効果の低下が観察されます。抗生物質に対する耐性病原細菌の出現並びに抗がん剤に対する耐性はがん治療の化学療法が始まって以来、治療戦略の歴史の中で簡単に解決できない大きな問題として現在まで続いています。
多くの抗がん剤に同時に耐性を示すがんの多剤耐性についてはP糖タンパク質/MDR1遺伝子が関与しています。
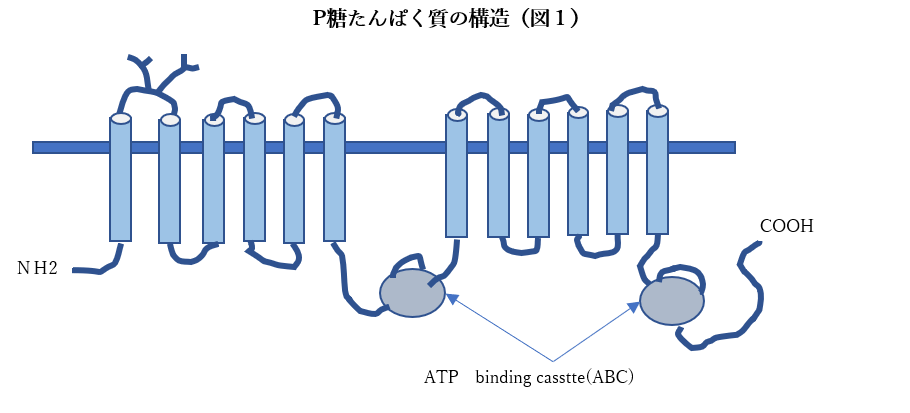
ABC輸送体は様々な細胞や組織、血液組織関門中で毒性化合物に対する重要な保護機能の役割をします。
このABC輸送体のたんぱく質は細胞に入ってくる毒性の物質をポンプのごとく細胞の外にくみ出すような機能を発揮して細胞自身を守るのです。これは『治療がつくりだす耐性』であり『治療を通じてのがんの進化』なのです。
殆どの生物に存在する膜貫通型ATP結合カセット(ABC)輸送体タンパク質ファミリーのこれらタンパク質は、悪性細胞から幅広い様々な治療化合物を積極的に排出することにより、がんの化学治療法耐性を引き起こします。
抗癌剤耐性に関与しているものとして、主に下記のABC輸送体が知られています。
P-glycoprotein(MDR1):
植物アルカロイドや抗がん剤を含む多くの疎水性薬剤を輸送します。
Multidrug resistance protein(MRP):
GSH抱合ロイコトリエンC4(LTC4)や17βエストラジオール-17-β-Dグルクロニド、硫酸エストロンのような広い範囲の抱合型親水性分子を輸送します。
Brest cancer resistance protein(BCRP):
トポテカンやミトキサントロン、ドキソルビシンを含むさまざまな抗がん剤を輸送します。
細胞が抗癌剤耐性を獲得する機序を遺伝子レベルの変異としてとらえると、(A)遺伝子 発現の亢進、(B)遺伝子発現の低下、(C)遺伝子変異、の 3 種類が考えられる。
薬剤耐性遺伝子の発現は長期に渡る化学療法によってもたらされるものであるが、そこには、がん抑制遺伝子とがん原遺伝子との間に密接な相関関係で繋がっています。
細胞に治療への耐性を与えるタイプの遺伝子変異は細胞の活動性をスローダウンさせる傾向があります。化学療法または標的療法が始まって『薬剤に反応する細胞』は死んでいくが、一部の細胞はほぼ確実に耐性を獲得し、ゆっくりとしたスピードで増殖していくのです。早く増殖している細胞を標的にするタイプの治療では対処できないのです。『治療が作り出す耐性』は最新の分子標的療法でさえこの問題が付きまとう。2019年末に発表された研究では大腸がんの細胞は特定の標的薬への反応としてDNA複製機構を活性化させることが分かったのですが、DNAの複製機構とはエラーを引き起こしやすいものなのです。また、
2012年有名な科学雑誌『ネイチャ―』に発表された論文ではテモダール(一般名テモゾロミド)で治療を受けた脳腫瘍患者さんにおいて、生き残っているがん細胞のDNAにこの新しい薬でしか生じない新しい変異が大量に見つかったと論じられています。
がんには一発で仕留められるような定まった標的がひとまとまりに存在しているのではなく適応と変化を繰り返す可変的で複雑なシステムが存在しているのだという概念を持つべきなのです。
ゲノムの守護神といわれるP53遺伝子の機能的な喪失また変異細胞は、化学療法薬に対する耐性の増加をもたらします。【p53-dependent regulation of MDR1 gene expression causes selective resistance to chemotherapeutic agents
.doi: 10.1073/pnas.94.20.11037 PMCID: PMC23579 PMID: 9380755】
1997年JDシューツらは、
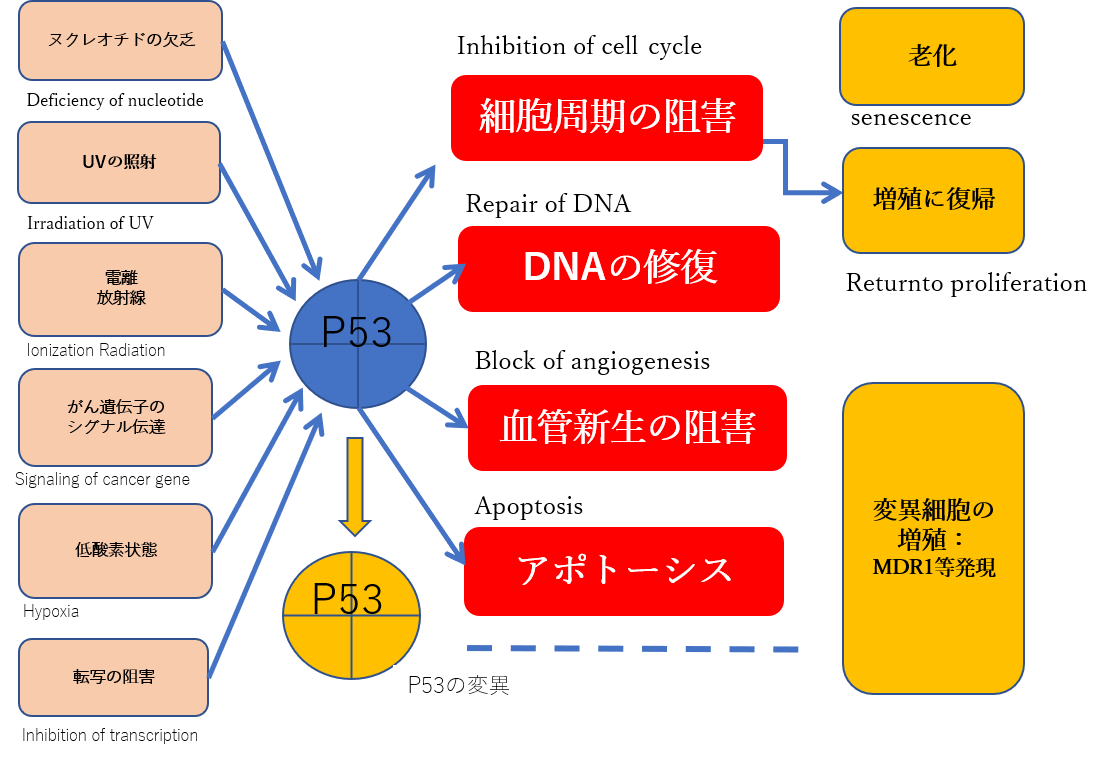 図2)ゲノムの守護神:p53に変異が引き起こされた細胞ではMDR1発現が高くなっている
図2)ゲノムの守護神:p53に変異が引き起こされた細胞ではMDR1発現が高くなっている
機能的なp53の喪失は、逆説的に化学療法薬に対する耐性の増加または減少をもたらす。p53の状態と薬物感受性との間の矛盾した関係は、化学療法剤の細胞傷害性応答に重要な遺伝子のp53の選択的調節を反映している可能性があるとし、癌に見られるp53不活性化は、MDR1発現のアップレギュレーションのために化学療法剤に対する選択的耐性をもたらす可能性が高いと発表しています。
また、2013年PeterAndorfer HansRotheneder らの発表によれば、Regulation of the MDR1 promoter by E2F1 and EAPP FEBS Letters Volume 587, Issue 10, 21 May 2013, Pages 1504-1509:長期化学療法の有効性を低下させる主な理由の一つである多剤耐性(MDR)はPGP(P糖たんぱく質)をコードするABCB1/MDR1遺伝子の発現上昇によって引き起こされる。そして、EAPP(E2F関連たんぱく質)はヒト腫瘍細胞の中で頻繁に過剰発現するたんぱく質で、p21遺伝子たんぱく質に依存的な細胞のアポトーシスを阻害すると指摘しておりEAPPがMDR1プロモーターを刺激し、PGPレベルが高くなることを示した。また、EAPPとは独立して、E2F1がMDR1プロモーターの活性を増加させるとP,ANdorferらは証明しています。
私たちの提唱している遺伝子治療では、E2Fは治療上、重要なターゲットになります。
E2F転写因子を不活化させるためにその上流から攻めていきます。その上流のターゲットとは、がん細胞にとって有益な『Cdc6たんぱく質』であり、このたんぱく質を作らせないように働きかけるRNA干渉※1の治療を実行させるRNAが『Cdc6shRNA‐ecm RV』である。Cdc6たんぱく質の発現を抑制することを第1の目的にCdc6shRNAを使用しますが、このたんぱく質を抑制することで、p16がん抑制遺伝子が活性化しCdk4/CyclinD~Rbがん抑制遺伝子の経路において、Rbたんぱく質の脱リン酸化をすることでRbたんぱく質は活性化しE2Fを不活化します。このような機序によりがん細胞の増殖を止めるとともにMDR1の活性化も減少させ、正常なp53の働きと合わせていくことでがん細胞のアポトーシスを誘導しやすい環境を整えます。
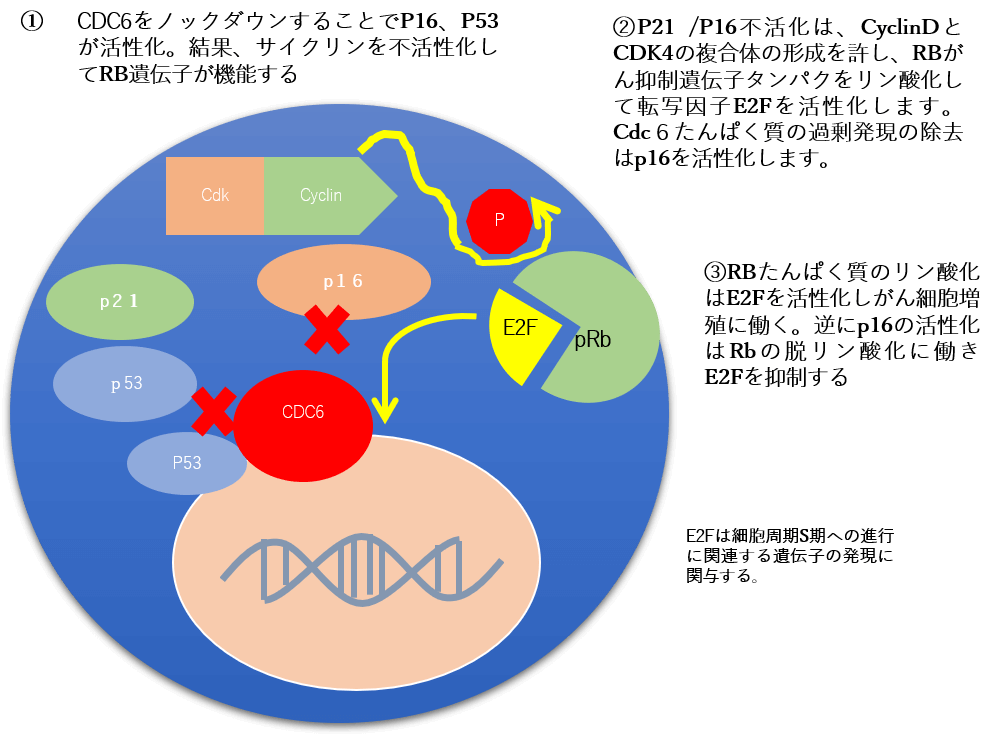 図3)細胞内で遺伝子経路
図3)細胞内で遺伝子経路
P53遺伝子はゲノムの守護神:過剰発現したCdc6たんぱく質をノックダウンすることで本来のP53の働きを取り戻し、『結末への道筋:アポトーシス』という細胞死をもたらす機能回復を治療の目的とします。がん細胞を殺すという考え方とは少し違います。 Cdc6ノックダウンRNA干渉とp16がん抑制遺伝子、P53がん抑制遺伝子を併用することで化学療法の走行性の向上と可逆的に発生してくる薬剤耐性に対処することが私たちの遺伝子治療の戦略の一つです。
【アポトーシス】とは、細胞が自ら死滅するように命令されるプログラムされた細胞死といいます。正常な状態を保てないほどの物理的、化学的ストレスを受けた場合、 このような時、たいていの場合、ストレス過多になる前にストレスが細胞死のプロセス、すなわちアポトーシスを引き起こすのです。 では、がん治療におけるアポトーシス誘導とはいかなるものか? がん細胞とは細胞に突然変異が生じて細胞社会の中で抑制が効かなくなり、勝手なふるまいによって無限に増殖する能力を獲得しています。 私たちに本来備わっている腫瘍抑制機能である 『アポトーシス』を回避する行動パターンを獲得しているのです。
私たちが持っている染色体17番にコードされたP53 たんぱく質を作りだすレシピーが忘れられてしまい書き換えミスで正常なP53たんぱく質が作れない状態が『p53の変異』と言えます。 がん細胞の50%以上がこのp53の変異もしくは欠損が確認されています。アポトーシスの道筋を回避した細胞にはさらに不老不死の能力としてテロメラーゼ酵素というがんにとっての最高のサプリメントを入手している。
テロメアがあるところまで減ったらその細胞は死にます。ところががん細胞はテロメラーゼという酵素を作り出す遺伝子を活性化させていて細胞が分裂するたびに短くなるテロメアを元の長さに戻す働きをするテロメラーゼ酵素を作り出す遺伝子を利用してテロメア時計のカウントダウンから逃れて『不老不死』、『無限の増殖』機能を得ているのでした。
がん治療のステージでは悪者のようなテロメアですが、私たちはこのテロメラーゼを誕生の際にうまく利用してきました。
胚性幹細胞は発生段階で身体のすべての組織を作らなければならないのでヘイフリックの限界を突破して細胞増殖を繰り返す必要があったのです。
がんのメカニズムを語るときにがんの原因となっていると考えられる遺伝子は私たち生命の誕生時には重要な働きをしている遺伝子であり、決してがんという『悪性新生物』を作りだす原因であるからといって排除されるべきものではないのです。
我々は、生物学的にこのがんの特徴を理解して利用する必要があるのです。
腫瘍細胞の90%以上は、テロメラーゼ酵素が活性化しています。つまりテロメラーゼ酵素を作り出す遺伝子がスイッチオンの状態なのです。私たちはこのテロメラーゼの活性化を利用してがん細胞にだけ特異的に作動させるように考えました。私たちが開発した『Cdc6shRNA‐ecmRV』は、がん細胞の繰り返されるDNAの修復作業に必要なCdc6たんぱく質を作り出す指令を受け取ったメッセンジャーRNAに対して相補的なsiRNA※1であり、RNA干渉治療※2を腫瘍細胞内で引き起こすためにhTERT(人テロメラーゼ逆転写酵素)をプロモーターとしています。
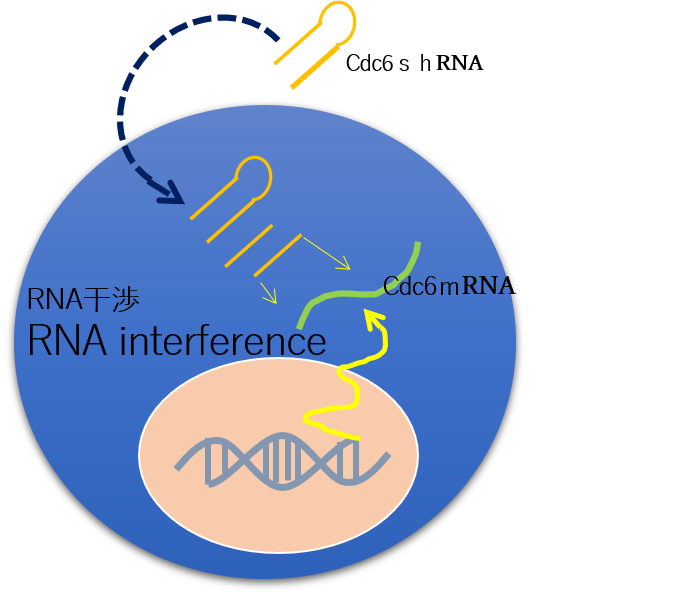
これに『p53encordingRNA-ecmRV』の作用で腫瘍細胞をアポトーシスに導きます。
この遺伝子治療用RNAが『ecmRV2022M4型』です。
Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin
私たちはいち早く腫瘍内にGSDMEを発現させるRNAの作成を試みました。そして、化学療法によって引き起こされるピロトーシスとアポトーシスのさまざまな細胞死を利用して遺伝子治療から免疫細胞の貪食作用を利用する『結末への道筋』の工程を治療に取り入れる研究を進めています。
化学療法によるカスパーゼ3の活性時にはGSDMEに依存的にピロトーシスを呈することは2017年Fengshaoらにより科学雑誌『ネイチャー』に発表されています。
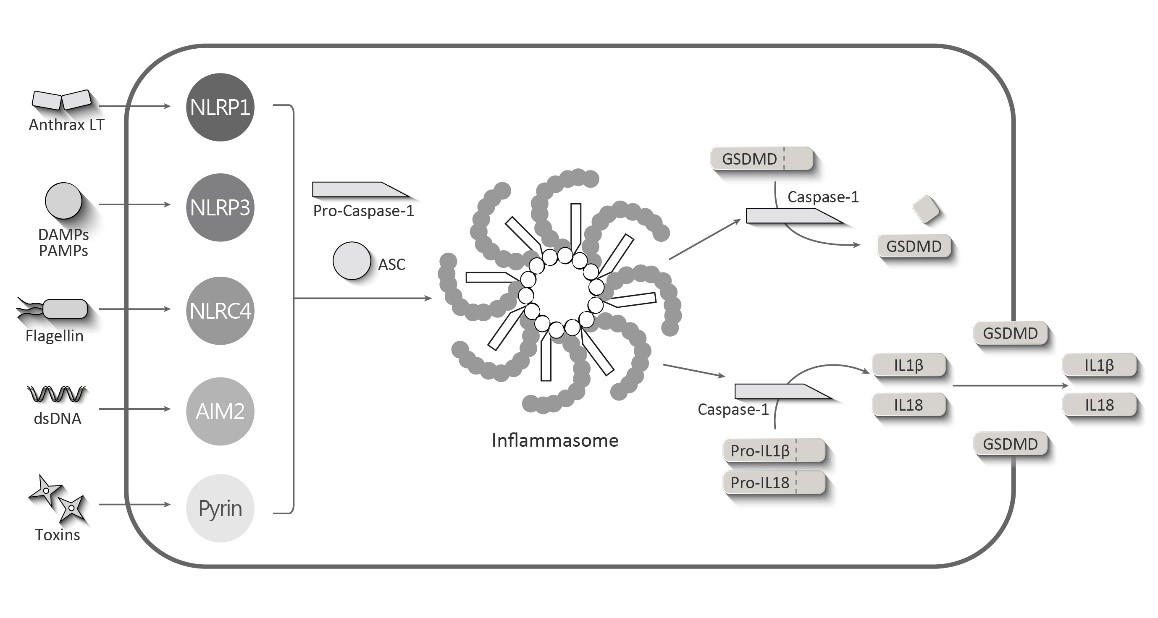 図4)インフラソーマとGSDMDの関係図
図4)インフラソーマとGSDMDの関係図
Caspase-1 により切断された GSDMD の N 末端が細胞膜上で孔形成し、細胞質成分を流出させることでパイロトーシスを引き起こすことが知られていますが、さらに、同じ Gasdermin family に属する Gasdermin E(GSDME)も Caspase-3 により切断され、パイロトーシスを惹起することが報告された。一方、GSDMEを介してCaspase-1欠損下でのパイロトーシスを惹起することが分かりました。
Toxins(毒素)dsDNA(ダブルストランドDNA:バクテリアやウィルスの二重鎖)Flagellin(最近の鞭毛を構成するたんぱく質)DampsPamp(PAMPS;Pathogen-associated molecular patterns;外来微生物に特有で共通する構成成分/DAMPS:damage-associated molecular patterns:組織損傷の兆候はダメージを受けた細胞や細胞外基質から放出される成分)Anthrax(炭素菌)といった細胞に対するDanger signalを迅速に認識することで免疫系の活性化が開始されます。これらのdanger signalを受け止める受容体(Pattern Recognaition Receptors:PRR)は存在様式を大きく2種類に分けられます。一つは細胞外の微生物に共通した構造を認識するTLRs(Toll like Receptor)です。もう一つが細胞質で働くPRRであるNLR(NOD‐like receptor)といった受容体で微生物由来の成分に加えて傷害を受けた細胞から放出されるDAMPSであるdsDNA、ATP、尿酸結晶、環境因子で炎症の原因となるアスベストやシリカ、またアジュバンドとして使われる水酸化アルミニウムなどを認識します。活性化したNLRはアダプター役のたんぱく質ASCを介してPro Caspase1を会合させてインフラソームを形成しIL-1やIL18の前駆体を切断して成熟化させます。
ASC(apoptosis-associated speak-like protein containing a CARD)、speak(細胞質内にできる凝集塊)195アミノ酸からなるCARDタンパク質でこのN末側にドッキングタンパク質と呼ばれる分子が介在し巨大な複合体のインフラソーマを形成する
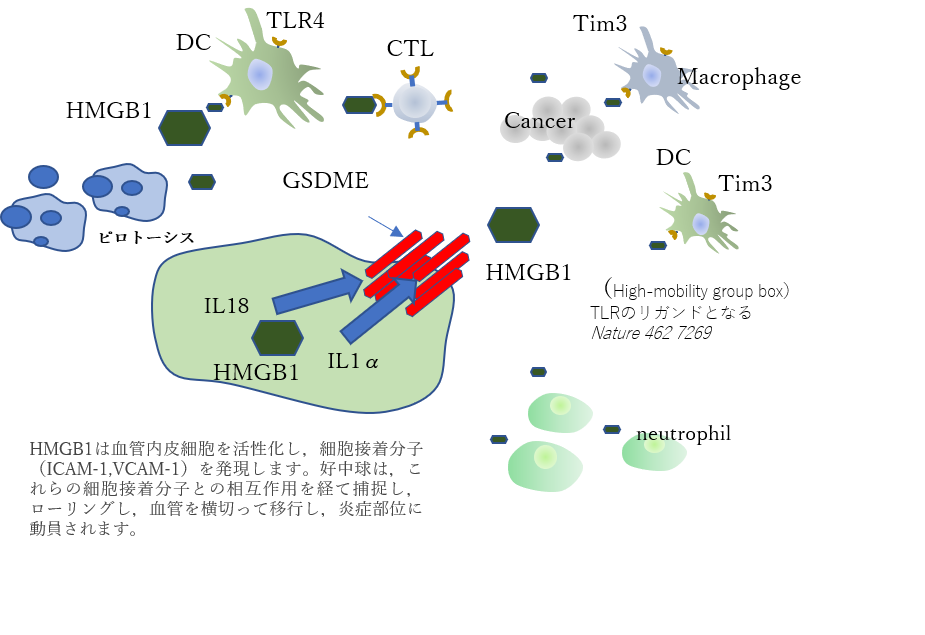 図5)細胞死と免疫のクロストークのポイントはHMGB1
図5)細胞死と免疫のクロストークのポイントはHMGB1
がん細胞にはこのHMGB1が高度に発現していてこれらの放出を放置してしまえば、再びこれがNF-k Bの活性化を介して細胞の生存・増殖を助長していることも報告されています。
したがって、アポトーシスやピロトーシスといったメカニズムを動員して様々な細胞死でがん細胞を減少させるのですが、治療によって放出された様々な分子の後始末を免疫細胞にお願いしなければなりません。
いわば生体内での様々分子の掃除をすることが結末への道筋であるのです。











